O século XIX apresentou progressos notáveis na área da ciência química, mas poucos contribuíram diretamente para nosso conhecimento da natureza dos átomos. Não houve maior progresso nessa área enquanto não se conheceu melhor a natureza da eletricidade.
Michael Faraday (1813-1834) encontrou uma relação precisa entre a quantidade de eletricidade necessária e a quantidade de transformação química que ocorre na eletrólise. A relação entre corrente elétrica e transformações químicas evoluiu na eletroquímica moderna.
OS TUBOS DE RAIOS CATÓDICOS
Nos anos que se seguiram a 1855, quando se desenvolveu os tubos de raios catódicos, muitos cientistas estudaram as propriedades da eletricidade. Um tubo de raios catódicos simples é um tubo de vidro em que foi feito vácuo, tendo em cada extremidade eletrodos de metal, um negativo (cátodo) e um positivo (ânodo). Quando se aplicam altas voltagens aos eletrodos, os raios catódicos (correntes de elétrons) fluem do cátodo para o ânodo.
Tubos de raios catódicos
A DETERMINAÇÃO DA RELAÇÃO CARGA / MASSA DO ELÉTRON
Uma vez que os raios catódicos são um fluxo de elétrons, aqueles constituem um meio ideal para o estudo das propriedades dos elétrons. Os raios que se movem em linha reta são independentes do material dos eletrodos e do gás residual que existe no tubo. Eles tornam as paredes do tubo
Com os raios catódicos, é um pouco mais complicado do que com bolas de golfe, porque o efeito do vento é substituído por um campo elétrico e um campo magnético, que agem sobre o elétron carregado negativamente. O desvio produzido é proporcional à carga do elétron e inversamente proporcional a sua massa. Visto que esse tipo de medida dá apenas uma resposta, encontramos na experiência de Thomson somente o valor da relação carga / massa.
MODELO DE THOMSON
O átomo de Dalton era neutro, ou seja, não possuía cargas elétricas. Como explicar, então, a atração existente entre um pedaço de vidro e um pano de lã, após serem atritados um contra o outro? Se os átomos fossem neutros, não poderíamos presenciar tal fenômeno. Ao atritarmos o bastão de vidro com um pedaço de lã, ocorre uma troca de cargas elétricas negativas entre os dois, de modo que o vidro fica com falta de cargas negativas, e a lã, com excesso de cargas negativas.
Esse bastão, já carregado pelo atrito, pode atrair uma bolinha de papel inicialmente neutra.
Como o vidro, a lã e o papel também são formados por átomos, e os átomos devem possuir cargas elétricas positivas e negativas.
Thomson, a partir de seus experimentos com os tubos de raios catódicos, criou um modelo em que o átomo era formado por cargas positivas e negativas.
Tal modelo foi chamado de “pudim de ameixas ou pudim de passas”. A massa desse pudim era formada pelas cargas positivas e deveria estar recheada com cargas negativas, as passas. Esse modelo é capaz de explicar tais atrações.
Para Thomson, o átomo era uma esfera positiva e eletricamente neutra, devido às cargas negativas espalhadas por toda a sua extensão. Com esse modelo, começava-se a admitir a divisibilidade do átomo e a reconhecer a natureza elétrica da matéria. Para você entender melhor o que era esse modelo, compare o átomo de Thomson a um panetone de forma esférica. Os pedaços de frutas cristalizadas em seu interior e na periferia seriam as cargas negativas espalhadas na massa positiva.
A DETERMINAÇÃO DA CARGA DO ELÉTRON
Várias tentativas foram feitas para resolver se a carga elétrica poderia ter qualquer grandeza ou somente variar em estágios, por incrementos regulares. Robert Andrews Millikan e seus colaboradores determinaram a evidência experimental que solucionou o problema. Millikan descobriu que, se gotículas de óleo fossem pulverizadas em uma pequena câmara, era possível observar o movimento de uma única gota com o microscópio. Devido à ação da gravidade, a gotícula cai através do ar com uma velocidade uniforme, que é determinada pelo seu tamanho e pela temperatura e pressão no aparelho. Este é mostrado de forma esquemática na figura a seguir.
Nos experimentos de Millikan, a maioria das gotículas tornavam-se eletricamente carregadas pelo atrito durante o processo de pulverização ou por outras causas. Era possível alterar a velocidade de queda das gotículas pela aplicação de um potencial elétrico entre as placas de metal colocadas nas partes superior e inferior da câmara. Realmente, pela ação da força elétrica produzida pela diferença de potencial, uma determinada gotícula carregada poderia ter sua velocidade de queda aumentada ou diminuída, ser forçada a parar ou ainda a movimentar-se para cima. Quando a diferença de potencial elétrico entre as placas era exatamente suficiente para fazer parar a gotícula, a força gravitacional e a força elétrica estavam equilibradas. Medindo-se separadamente a massa da gotícula, foi possível calcular a força elétrica necessária para manter a gotícula estacionária.
Utilizando os seus dados experimentais e a Lei de Coulomb (que relaciona a carga e a distância com a força), Millikan conseguiu calcular a grandeza da carga da gotícula. O seu aparelho pode ser considerado como uma balança delicada para comparar forças gravitacional e elétrica.
Millikan descreveu suas conclusões acerca da carga elétrica com estas palavras: Realmente, deste modo eu observei a captura de vários milhares de íons e nunca encontrei um, cuja carga, quando medida como anteriormente, não tivesse exatamente o mesmo valor da menor carga capturada, ou um múltiplo muito pequeno desse valor. Aqui, portanto, está uma prova direta e inatacável de que o elétron não é uma média estatística, mas que as cargas elétricas encontradas nos íons têm todas o mesmo valor ou, então, múltiplos inteiros e pequenos desse valor.
* MILLIKAN, R. A. Electrons (+ and –), Protons, Photons, Neutrons, and Cosmic Rays. Chicago: The University of Chicago Press, 1935. p. 72.
A partir desses dados, Millikan calculou a carga do elétron como sendo de 1,591x10–19 coulombs. Entretanto, a conclusão qualitativa é mais importante do que o resultado quantitativo. O valor de qualquer carga negativa corresponde a múltiplos de uma carga unitária, que é a carga do elétron.
Até hoje, ninguém conseguiu produzir ou demonstrar a existência de carga negativa de grandeza menor do que 1,591x10–19 coulombs; atualmente, o valor mais preciso é 1,60186x10–19 coulombs.
Para explicar as observações experimentais, concluiu-se que as cargas dos íons devem diferir em pequenas quantidades ou que as massas desses íons devem diferir. A partir do trabalho de Millikan, parece que pelo menos a carga negativa aparece em unidades discretas, mas Millikan trabalhou com gotículas de óleo que continham inicialmente cargas positivas e negativas. Entretanto, todas as cargas positivas e negativas que ele observou eram sempre múltiplas de uma carga unitária, a carga do elétron. Se, na matéria, os elétrons são unidades de carga negativa que neutralizam unidades de carga positiva, essas cargas negativas e positivas devem vir em conjuntos de grandeza igual. Se assim não fosse, as cargas negativas e positivas em um objeto nem sempre dariam exatamente zero ou um múltiplo inteiro da unidade de carga eletrônica. Como podem ser interpretados os dados experimentais que indicaram variações da relação carga / massa nos íons positivos?
A única maneira de responder essa pergunta parece exigir que os átomos de um mesmo elemento difiram em massa, surgindo, assim, a ideia de que elementos químicos podem apresentar isótopos, mas tal resposta contradiz a teoria de Dalton, que, no entanto, provou ser adequada à interpretação das observações feitas em sistemas químicos.
A EXPERIÊNCIA DE RUTHERFORD
Lord Ernest Rutherford foi o homem que revolucionou o conceito de átomo.
A partir da realização de uma experiência que consistia no bombardeamento de uma radiação emitida pelo polônio (Po) sobre uma fina placa de ouro (da espessura de uma folha de papel), Rutherford derrubou os modelos anteriores, mostrando ao mundo um modelo mais completo do que os iniciais.
A experiência de Rutherford
O elemento radioativo polônio foi colocado em uma caixa de chumbo com uma pequena abertura por onde sairia um feixe de partículas radioativas com cargas positivas, chamadas de partículas alfa (α).
Houve a necessidade de se colocar placas de chumbo com pequenos orifícios em seus centros, para direcionar o feixe, a fim de atingir a lamínula de ouro.
OBSERVAÇÃO
O chumbo foi utilizado pois é um material muito denso que evita o espalhamento da radiação.
Envolveu-se todo o sistema com um filme fluorescente que serviria para demonstrar se as partículas atravessariam ou refletiriam ao se chocarem com a lamínula de ouro. Quando uma partícula alfa se chocava com esse filme, havia uma emissão de luz que provocava, no ponto onde houve o choque, uma mancha.
Durante a realização desse experimento, Rutherford observou que a maioria das partículas alfa que chegaram a se chocar com a lamínula de ouro conseguiu atravessá-la.
No filme fluorescente, manchas centrais foram causadas pelas partículas que atravessaram a lamínula. As manchas das extremidades do filme foram causadas pelas partículas refletidas.
Rutherford descreveu seu trabalho com as seguintes palavras: “Eu gostaria de usar este exemplo para mostrar o quão frequentemente descobrimos fatos importantes por acidente. Nos primeiros dias, eu havia observado o desvio de partículas alfa, e o Dr. Geiger havia examinado esse fenômeno com detalhe, em meu laboratório, verificando que, em pedaços finos de metal pesado, o desvio era usualmente pequeno, da ordem de um grau. Um dia Geiger chegou-se a mim e disse: Você não acha que o jovem Marsden, que estou treinando em métodos radioativos, deveria iniciar uma pequena pesquisa? Como eu também havia pensado nisso, respondi: Por que não deixar que ele verifique se algumas partículas alfa podem ser desviadas de um grande ângulo? Devo confessar que eu não acreditava que isso acontecesse, uma vez que sabíamos que a partícula alfa era muito rápida, pesada e com uma grande quantidade de energia, e poder-se-ia prever que, se o desvio total era devido ao efeito acumulado de uma série de pequenos desvios, a possibilidade de uma partícula alfa voltar para trás era muito pequena. Lembro-me, então, que dois ou três dias mais tarde Geiger chegou muito excitado, dizendo: Fomos capazes de obter algumas partículas alfa que retornaram em direção à fonte. Foi, talvez, a coisa mais incrível que já me aconteceu. Foi quase tão inacreditável como se atirássemos uma granada de 15 polegadas contra uma folha de papel e ela voltasse, atingindo-nos. Refletindo sobre o assunto, constatei que esse retorno deveria ser o resultado de uma única colisão e, quando fiz alguns cálculos, verifiquei ser impossível obter qualquer coisa dessa ordem de grandeza, a não ser que se tivesse um sistema onde a maior parte da massa do átomo estivesse concentrada em um núcleo diminuto. Foi, então, que idealizei o átomo como tendo um pequeno centro maciço e dotado de carga. Calculei matematicamente quais as leis que o desvio deveria obedecer e descobri que o número de partículas desviadas de um determinado ângulo deveria ser proporcional à espessura da lâmina metálica, ao quadrado da carga nuclear e inversamente proporcional à quarta potência da velocidade. Essas deduções foram mais tarde confirmadas por Geiger e Marsden em uma série de belos experimentos.
RUTHERFORD, Ernest. The Development of the Theory of Atomic Structure, 1936. In: NEEDHAM, J.; PAGE, W. J. Background to Modern Science. New York: The MacMillan Company, 1938
As conclusões iniciais de Rutherford
Os resultados foram explicados supondo-se que o átomo possui um centro ou um núcleo de diâmetro muito pequeno, onde estão concentradas cargas elétricas de um único tipo. Esse núcleo carregado deve ser muito maciço ou mantido fixo por forças existentes dentro do sólido, ou ambas as coisas, pois algumas das partículas alfa são bastante desviadas de seu trajeto original. Como os elétrons têm carga negativa, deve-se concluir que esse núcleo central maciço é carregado positivamente e que o desvio das partículas alfa positivas é o resultado de uma repulsão eletrostática.
De acordo com os cálculos de Rutherford, o raio do núcleo é cerca de 1/10 000 do raio do átomo, ou mesmo menos que isso. Como o volume de uma esfera é proporcional ao cubo do seu raio, o volume de um átomo deve ser 1012 vezes maior que o volume do seu núcleo. Como a maior parte da massa de um átomo está concentrada no núcleo, a densidade deste deve ser, pelo menos, 1012 vezes maior que a densidade do átomo. Se isso for verdade, então os elétrons devem ocupar um volume muito maior do que o do núcleo.
Se, na realidade, um núcleo carregado positivamente é o responsável pelo desvio de partículas alfa positivas (devido à repulsão coulômbica), então o número de partículas alfa desviadas de um dado ângulo dependerá da grandeza da carga do núcleo. Núcleos de alta carga, evidentemente, desviarão de um determinado ângulo mais partículas alfa do que núcleos de carga pequena.
Rutherford deduziu a relação matemática que descreve como os números relativos de partículas alfa desviadas de um dado ângulo dependem da carga nuclear. H. Geiger e E. Marsden verificaram ser possível atribuir um valor numérico para a carga nuclear de carbono, alumínio, ouro e outros metais. Descobriram também que essa carga nuclear era, aproximadamente, igual à metade da grandeza da massa atômica, desde que a carga nuclear positiva fosse expressa em unidades de grandeza igual à carga do elétron.
Modelo de Rutherford
A partir dessas conclusões, Rutherford propôs um novo modelo atômico: o modelo “planetário”, em que o átomo é comparado com o sistema solar. O núcleo central positivo, pequeno e denso, com elétrons girando em órbitas circulares ao seu redor, como os planetas giram em torno do Sol.
PARTÍCULAS SUBATÔMICAS
Os prótons, os nêutrons e os elétrons formam conjuntos denominados átomos. Um átomo é um conjunto formado por um certo número de prótons e nêutrons, constituindo um núcleo, ao redor do qual gira um número de elétrons igual ao número de prótons, que constitui a eletrosfera.
OBSERVAÇÃO
Note que a massa do nêutron é levemente maior do que a massa do próton. Já a massa do elétron é considerada desprezível, pois a massa de 1 836 elétrons é igual à massa de 1 próton.
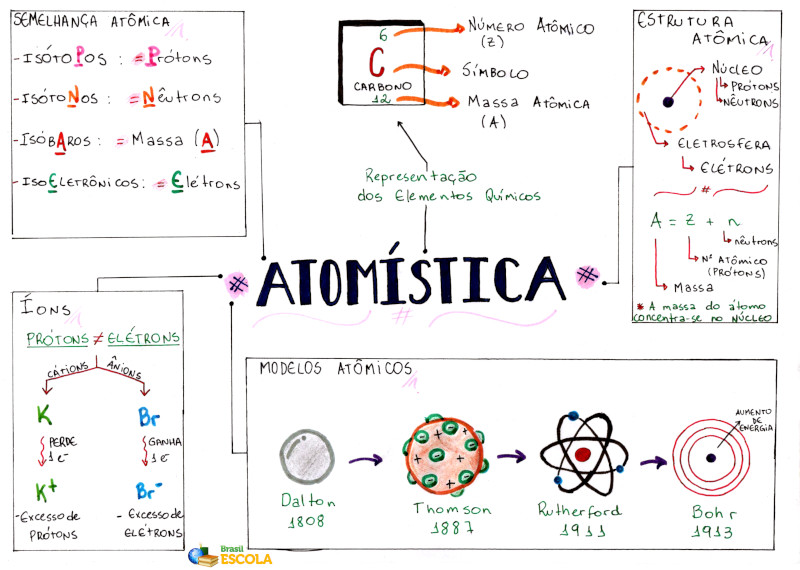
NÚMEROS QUÍMICOS
Número atômico (Z)
Os elementos químicos conhecido s podem se r colocados na ordem crescente de suas massas atômicas, a partir do elemento de menor massa, que é o hidrogênio. Pode-se também obter uma relação dos elementos, dispondo-os na ordem crescente do número de unidades de carga nuclear, obtido por Rutherford. Comparando-se essas duas relações, vê-se que a ordem dos elementos é praticamente a mesma. O número de unidades de carga positiva do núcleo do átomo de qualquer elemento químico é chamado número atômico desse elemento.
Rutherford pôde fazer apenas uma estimativa grosseira dos números atômicos dos elementos. Desde então, outros métodos têm fornecido dados mais precisos, que confirmaram plenamente as suas conclusões.
Um elemento químico pode agora ser definido de um modo diferente do processo operacional. A nova definição é essencialmente uma definição conceitual e estabelece que um elemento químico é um conjunto de átomos que têm todos o mesmo número atômico (carga nuclear).
O desenvolvimento da teoria dos átomos mostra que os números atômicos precisam ser números inteiros. Isso significa que, quando os elementos estão dispostos na ordem crescente de seus números atômicos, não pode, logicamente, haver um elemento colocado entre o hidrogênio e o hélio, ou seja, um elemento de número atômico 1,5. Se tal elemento for encontrado, nossas ideias atuais sobre átomos, eletricidade e sistemas químicos deverão sofrer uma transformação radical.
O número de partículas constituintes dos átomos é muito importante, pois é o que diferencia um átomo de outro. Na realidade, é o número de prótons do átomo que o caracteriza quimicamente. Esse número é importantíssimo e é chamado de número atômico, representado pela letra Z (número atômico Z é o número de prótons do átomo).
Dizemos que átomos do mesmo número atômico são átomos de um mesmo elemento químico.
Por definição:
Elemento químico é um conjunto de átomos de mesmo número atômico.
Assim, elemento químico hidrogênio é o conjunto de átomos de Z = 1. Elemento químico hélio é o conjunto de átomos de Z = 2, e assim por diante.
Cada Z corresponde a um único elemento químico e vice-versa.
Número atômico (Z) ⇔ Elemento químico
Os elementos químicos encontrados na natureza têm Z variando de 1 a 92. Artificialmente, a partir de 1942, foram obtidos elementos com Z > 92. Atualmente, já foi obtido o elemento de número atômico Z = 118, ao qual ainda não foi atribuído nome.
Número de massa (A)
O número de nêutrons de um átomo não interfere nas suas características químicas. Assim, átomos com diferentes números de nêutrons, mas com o mesmo número de prótons, são átomos do mesmo elemento químico. O número de prótons somado ao número de nêutrons interfere apenas na massa do átomo.
A massa do átomo é dada pelo seu número de prótons e nêutrons, pois a massa dos elétrons é desprezível em relação à dos prótons e à dos nêutrons. O número de prótons somado ao número de nêutrons de um átomo é chamado de número de massa e é representado pelo símbolo A.
Número de massa (A) de um átomo é o seu número de prótons somado ao seu número de nêutrons.
Quando um átomo é eletricamente neutro, o seu número de prótons é igual ao de elétrons. Como a carga elétrica de um próton é neutralizada exatamente pela carga elétrica de um elétron e vice-versa, para que o átomo seja uma partícula eletricamente neutra, o seu número de prótons deverá ser igual ao seu número de elétrons.
Representação de um elemento
Para representarmos um átomo de um elemento químico, geralmente colocamos o seu símbolo no centro, acima, o seu número de massa e, abaixo, o seu número atômico.
Observe que o número de massa é sempre maior do que o número atômico, pois A = Z + N, exceto no caso do isótopo prótio do hidrogênio, em que N = 0 ⇒ A = Z, (1H1). No caso de representarmos um íon, geralmente colocamos sua carga elétrica à direita e acima do símbolo:
Exemplo: 40Ca20 2+
SEMELHANÇAS ATÔMICAS
Isótopos
Átomos com igual número atômico (igual Z) e diferentes números de massa (diferentes A) são isótopos de um mesmo elemento químico.
Dizemos que isótopos de um mesmo elemento são isótopos entre si. Assim, 1H, 2H e 3H são isótopos entre si, ou seja, são diferentes isótopos do mesmo elemento hidrogênio.
Isótopos entre si são isótopos do mesmo elemento, portanto, com o mesmo Z e com o mesmo número de prótons. Como os isótopos são átomos, também apresentam igual número de elétrons. Isótopos entre si diferem no número de nêutrons e, portanto, no número de massa (A). Veja na tabela a seguir o número de prótons, elétrons e nêutrons dos isótopos do hidrogênio, tomados como exemplos:
O carbono possui três isótopos naturais, que são:
6C12 (carbono-12): 98,89% (abundância na natureza) - possui seis prótons e seis nêutrons no núcleo;
6C13 (carbono-13): 1,01 a 1,14% (abundância na natureza) - possui seis prótons e sete nêutrons no núcleo;
6C14 (carbono-14): traços (abundância na natureza) - possui seis prótons e oito nêutrons no núcleo.
Observe que o nome dos isótopos é geralmente escrito da seguinte forma: nome do elemento + número de massa. Os únicos isótopos que possuem nomes próprios são os isótopos do hidrogênio, que são:
1H1: prótio ou hidrogênio (possui 1 próton e nenhum nêutron - 99,985%)
1H2: deutério ou hidrogênio pesado (possui 1 próton e 1 nêutron - 0,015%);
1H3: trítio ou hidrogênio superpesado (possui 1 próton e 2 nêutrons – traços).
Isótopos de um mesmo elemento não têm nomes diferentes, porém, no caso do hidrogênio, foram dados nomes diferentes aos seus isótopos. Os isótopos dos demais elementos são nomeados com os próprios nomes dos elementos, acompanhados dos respectivos números de massa.
OBSERVAÇÃO Os isótopos também podem ser denominados átomos isoprotônicos (átomos que possuem o mesmo número de prótons).
Isóbaros
São átomos de elementos diferentes (com diferentes números atômicos) que apresentam o mesmo número de massa.
São átomos de elementos químicos diferentes (números atômicos diferentes) e mesmo número de nêutrons (N).
Os isótonos são também chamados isoneutrônicos (átomos que possuem o mesmo número de nêutrons).
Átomos neutros
São eletricamente neutros, ou seja, possuem quantidades de cargas positivas (prótons) e cargas negativas (elétrons) iguais.
Número de prótons = número de elétrons
Exemplos: O, N, S, F, Na, etc.
ÍONS
São espécies químicas eletricamente carregadas.
Os íons positivos são chamados de cátions e os negativos, de ânions. Quando um átomo neutro perde elétrons, ele se transforma em um cátion.
Quando um átomo neutro ganha elétrons, ele se transforma em um ânion.
Espécies isoeletrônicas
São espécies químicas com o mesmo número de elétrons.

















Nenhum comentário:
Postar um comentário