A
quantidade de compostos orgânicos conhecida é inúmeras vezes maior do que a de
compostos inorgânicos. Assim, bem maiores também são as possibilidades de
reações orgânicas. No entanto, estas seguem padrões mais ou menos bem
definidos, sendo possível agrupá-las, o que torna o seu estudo uma tarefa menos
árdua. As reações orgânicas se dividem principalmente em:
1. Reações de
adição: As mais comuns envolvem ruptura de ligação π
Algumas
reações, especialmente as de ácido-base de Lewis, envolvem apenas a formação de
ligações coordenadas e também são classificadas como reações de adição.
Observe
que nenhuma ligação foi rompida, apenas formaram-se ligações coordenadas entre
o íon ferro e os pares de elétrons não ligantes do oxigênio e do nitrogênio.
2. Reações de
eliminação: Envolvem eliminação de moléculas menores.
3. Reações de oxidação:
Envolvem aumento no estado de oxidação de pelo menos um átomo da molécula
orgânica reagente.
4. Reações de
substituição: Envolvem substituição de um átomo ou grupo de átomos.
5. Reações de polimerização: Envolvem a formação de polímeros.
5. Reações de polimerização: Envolvem a formação de polímeros.
Em
quase todos os casos (exceto nas reações ácido-base de Lewis, em que há apenas
formação de ligações), ocorre quebra de ligações dos reagentes e formação de
ligações dos produtos. A quebra pode ocorrer de duas formas:
•
Homolítica – os elétrons envolvidos na ligação se distribuem uniformemente
entre os átomos durante a ruptura da ligação, levando à formação de duas
espécies eletricamente neutras, denominadas radicais.
Reações
envolvendo espécies radicalares são favorecidas em fase gasosa, mas também
podem ocorrer em solução com solventes de baixa polaridade.
•
Heterolítica – o(s) par(es) de elétrons da ligação fica(m) apenas com um dos
grupos, levando à formação de espécies iônicas:
Reações
envolvendo espécies iônicas são favorecidas em solução, principalmente em
solventes polares.
Observe
que a cisão representada pela equação anterior envolveu a produção de um
cátion, com carga positiva no carbono. Essas espécies são denominadas
carbocátions e são razoavelmente instáveis. Devido à sua deficiência de
elétrons, os carbocátions reagem rapidamente com bases de Lewis. Em outras
palavras, eles buscam centros ricos em elétrons, sendo, por isso, denominados
eletrófilos.
Os
eletrófilos são reagentes que, nas respectivas reações, buscam elétrons extras
para formar espécies com maior estabilidade. Todos os ácidos de Lewis são
exemplos de eletrófilos.
Ainda
no exemplo anterior, o íon brometo (Br–) é capaz de doar par de
elétrons, sendo, dessa forma, uma base de Lewis. Espécies que, nas respectivas
reações, buscam próton(s) ou outro(s) centro(s) positivo(s) ao(s) qual(quais)
possam doar par(es) de elétrons são denominadas nucleófilos.
REAÇÕES
DE ADIÇÃO
As
reações de adição são características de compostos insaturados. Ocorrem pela
quebra de ligações pi (π), sendo adicionadas duas espécies à molécula para cada
ligação pi (π) quebrada.
Essas
reações são muito importantes do ponto de vista industrial, destacando-se a
hidrogenação catalítica de óleos vegetais para a fabricação da margarina.
Hidrogenação
catalítica
A
reação de adição de hidrogênio a alquenos e alquinos é denominada hidrogenação.
Embora
seja um processo altamente exotérmico, não ocorre com velocidade apreciável na
ausência de um catalisador. Os catalisadores mais comumente usados são platina,
níquel, paládio, ródio e rutênio, finamente divididos. Estes adsorvem as
moléculas de hidrogênio em sua superfície, enfraquecendo as ligações entre os
átomos no H2 e, assim, favorecendo a reação de hidrogênio com o
alqueno (ou alquino, quando for o caso).
Como
cada 1,0 mol de alqueno monoinsaturado apresenta 1,0 mol de ligação pi (π),
haverá consumo de 1,0 mol de H2 para cada mol do alqueno em questão.
Já
os alquinos monoinsaturados apresentam 2,0 mol de ligações pi (π) por mol do
composto, o que torna necessário o consumo de 2,0 mol de H2 para
cada mol do alquino correspondente:
No
entanto, os alquinos também podem ser parcialmente hidrogenados, desde que se
escolha um catalisador especial, levando à produção do alqueno correspondente.
Nesse caso, será rompido apenas 1,0 mol de ligação pi (π) por mol de alquino
monoinsaturado.
Embora
as reações de hidrogenação sejam características de alquenos e alquinos, os
cicloalcanos que apresentam anéis com 3 e 4 átomos de carbono (ciclopropano e
ciclobutano) também podem ser hidrogenados. Estes não apresentam ligações pi
(π), mas seus anéis são muito tensionados. Isso gera instabilidade nos compostos,
o que favorece a ruptura dos anéis e sua hidrogenação.
Cicloalcanos
maiores, tais como ciclopentano ou cicloexano, apresentam conformações que lhes
garantem maior estabilidade; logo, eles não são facilmente hidrogenados.
Halogenação
Os
alquenos, assim como os alquinos, podem ser convertidos em haletos orgânicos
por adição de halogênio (X2) à ligação dupla ou tripla. Nesse
processo, a ligação pi (π) entre os átomos de carbono é rompida, e cada um dos
átomos da molécula de X2 se liga a um carbono que continha a ligação
pi (π).
Entre
os halogênios, os mais utilizados nesse processo são Cl2 e Br2.
A reação ocorre rapidamente na ausência de luz e misturando-se os reagentes em
um solvente inerte, tal como o tetracloreto de carbono (CCl4).
A
adição de bromo, na qual se utiliza bromo dissolvido em CCl4,
constitui um teste extremamente útil e simples para identificar ligações
múltiplas carbono-carbono. Isso porque a solução de bromo, que inicialmente é
marrom-avermelhada, se descolore, pois o di-haleto formado é incolor
Adição de
haletos de hidrogênio
Os
haletos de hidrogênio apresentam ligações H—X (sendo X, principalmente, Cl, Br
e I) muito polarizadas e podem reagir facilmente com compostos que apresentam
ligações múltiplas carbono-carbono.
A
adição de H—X a um alqueno pode levar à formação de dois produtos. No entanto,
um predomina sobre o outro.
A
análise de muitos outros exemplos semelhantes levou o químico Vladimir
Vasilyevich Markovnikov, por volta de 1870, a propor a regra conhecida como
Regra de Markovnikov, cujo princípio é:
Na adição de H—X a um alqueno, o átomo de hidrogênio se
liga ao átomo de carbono da dupla-ligação que tem o maior número de átomos de
hidrogênio.
Observe
que a Regra de Markovnikov não explica o porquê de o 2-bromopropano ser o
produto principal. Tal explicação é possível ao se analisar o mecanismo a
seguir:
Na
primeira etapa do mecanismo, há formação de um cátion com carga positiva no
carbono (carbocátion). A formação do produto principal será tanto mais
favorecida quanto maior for a estabilidade relativa desse carbocátion. Esta,
por sua vez, será tanto maior quanto maior for a sua capacidade de acomodar a
carga positiva. Assim, grupos que doam densidade eletrônica ao carbono (como
fazem os grupos alquilas) dispersam sua carga, estabilizando o carbocátion.
Logo, quanto maior for o número de grupos alquilas diretamente ligados ao
carbono que contém a carga positiva, maior será sua estabilidade relativa e,
portanto, mais favorável será a formação do produto principal. Dessa forma:
Entendido
então o mecanismo de adição de haletos de hidrogênio, a Regra de Markovnikov
pode ser, então, enunciada da seguinte maneira:
Na
adição de um reagente assimétrico a uma dupla-ligação, a parte positiva do
reagente adicionado liga-se ao átomo de carbono da dupla-ligação, de modo a
formar, como intermediário, o carbocátion mais estável.
No
exemplo seguinte, como esperado, ocorre a formação do 2-bromo-2-metilbutano.
Mas
cuidado: Se a adição de HBr ocorrer na presença de peróxidos (seja ele inorgânico
tal como H2O2 ou orgânico tal como CH3CH2—O—O—CH2CH3),
ela será anti-Markovnikov, ou seja, o hidrogênio se liga ao carbono menos
hidrogenado. De acordo com Kharasch e Mayo, a reação ocorre segundo o mecanismo
a seguir:
Observe
que não há formação de carbocátion, e sim de um radical com um elétron
desemparelhado no carbono. A estabilidade relativa deste segue a mesma ordem
dos carbocátions. Sem peróxidos, é o hidrogênio a primeira espécie a ser
adicionada, enquanto com peróxidos, é o bromo.
Adição de
água – hidratação
A
adição de água, catalisada por ácidos (usualmente ácido sulfúrico ou fosfórico
diluído), à dupla-ligação de um alqueno constitui um importante método
industrial para preparação de álcoois de baixa massa molar. A reação segue a
Regra de Markovnikov, logo, não possibilita a obtenção de álcoois primários.
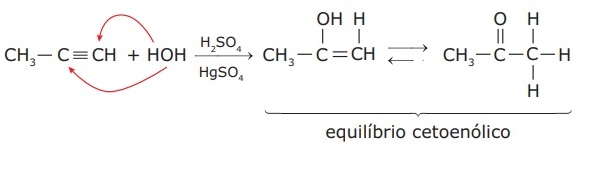
Para alquinos, é possível adicionar apenas uma molécula de água por
ligação tripla. A reação é catalisada por sais de mercúrio e se deve ao
equilíbrio cetoenólico ou aldoenólico. Como a presença da carbonila, seja da
cetona, ou do aldeído, permite ao composto maior estabilidade em relação ao
enol equivalente, o enol se converte:
REAÇÕES
ENVOLVENDO A CARBONILA
Aldeídos
e cetonas podem ser convertidos em uma grande variedade de classes de compostos.
A reação mais característica é a adição à dupla-ligação carbono-oxigênio. No
entanto, algumas reações que envolvem a redução do carbono da carbonila também
são de grande importância.
Adição de cianeto de hidrogênio
A
adição de cianeto de hidrogênio possibilita a introdução de um átomo de carbono
à molécula orgânica. O produto formado pode reagir em etapas posteriores,
formando compostos de grande interesse químico. No entanto, essas etapas
subsequentes fogem do objetivo desse estudo.
As
reações de eliminação constituem outro importante grupo de reações orgânicas.
Envolvem a remoção de átomos ou grupos de átomos de uma molécula sem que sejam substituídos
por outros. Na maioria dos casos, os átomos ou grupos são removidos de carbonos
adjacentes, resultando na formação de uma ligação múltipla.
Exemplos:
DESIDROALOGENAÇÃO
DE HALETOS DE ALQUILA
A
desidroalogenação constitui um bom método na síntese de alquenos. A reação
consiste em remover um átomo de hidrogênio e um átomo de halogênio ligados a
carbonos adjacentes. Para tal, utiliza-se um solvente adequado, entre eles o
hidróxido de potássio dissolvido em etanol (denominado potassa alcoólica).
Considere
agora a desidroalogenação do 2-bromo-2-metilbutano. Há dois hidrogênios de
grupos diferentes adjacentes ao carbono que contém o bromo que são possíveis de
serem eliminados.
No
entanto, o 2-metilbut-2-eno é o produto principal da reação.
Sabe-se
que os alquenos serão tanto mais estáveis quanto mais substituídos forem.
Assim, a formação do 2-metilbut-2-eno é favorecida, pois este constitui o
alqueno mais estável.
Esse
comportamento foi observado pela primeira vez pelo químico russo Alexander
Saytzeff, em 1875. Sem conhecer o mecanismo reacional, ele formulou a seguinte
regra, conhecida hoje como Regra de Saytzeff:
Na desidroalogenação, o produto da reação que se forma,
preferencialmente, é o alqueno que tiver o maior número de grupos alquila
ligados aos átomos de carbono da ligação dupla.
DESIDRATAÇÃO
DE ÁLCOOIS
A
desidratação de um álcool consiste na eliminação do grupo hidroxila de um
carbono e um hidrogênio de outro átomo de carbono (ou outro grupo reagente) com
formação de uma molécula de água.
A
reação, que naturalmente seria excessivamente lenta, precisa ser catalisada por
ácidos e aquecida. Os ácidos geralmente empregados são os ácidos sulfúrico ou
fosfórico concentrados. A alta concentração desses ácidos é importante, visto
que as desidratações são reversíveis e isso possibilita um baixo percentual de
água na mistura reacional, favorecendo, dessa forma, a reação direta.
Há
duas possíveis formas de desidratações:
1. O grupo hidroxila e
o átomo de hidrogênio são eliminados de carbonos adjacentes.
No
primeiro caso, os grupos eliminados pertencem à mesma molécula, sendo a reação
denominada desidratação intramolecular, e, como produto, tem-se um alqueno. Já
no segundo caso, o hidrogênio e a hidroxila são eliminados de moléculas
diferentes, sendo a desidratação intermolecular, e, como produto, tem-se um
éter.
No
caso da desidratação intermolecular, a reação ocorre em condições mais brandas
de temperatura, por exemplo:
Entretanto,
esse método tem utilização limitada, visto que álcoois secundários e terciários
sofrem desidratação intramolecular mais facilmente. Lembre-se de que a
desidratação leva à formação de carbocátions e que carbocátions primários
apresentam baixa estabilidade quando comparados aos secundários ou terciários.
Para álcoois terciários, em geral, o produto é exclusivamente o alqueno mais
substituído, ou seja, não se produz éteres partindo-se de álcoois terciários.
As
reações de desidratação intermoleculares em álcoois podem ser classificadas
como reações de eliminação, considerando-se o seguinte critério: essas reações,
a partir de reagentes orgânicos, originam um produto orgânico e outro
inorgânico. Tal classificação não leva em consideração o mecanismo do processo,
ou seja, as etapas que conduzem à formação de produtos nesse tipo de reação.
Também são exemplos dessa abordagem as reações de descarboxilação e as reações
de desidratação intermoleculares em ácidos carboxílicos.
No
exemplo a seguir, o etanol sofre ruptura de uma ligação sigma e formação de
outra ligação sigma no processo reacional, ou seja, um grupo foi substituído
por outro. Considerando-se o mecanismo do processo, essa reação deveria ser
classificada como uma reação de substituição.
Entretanto,
como a partir de uma substância orgânica (etanol) houve a formação de uma outra
substância orgânica (éter etílico) e uma inorgânica (água), essa reação de
desidratação pode ser classificada como uma reação de eliminação.
ELIMINAÇÃO
DE HALETOS VICINAIS
Os
dialetos vicinais são compostos dialogenados que têm os halogênios ligados a
átomos de carbonos adjacentes.
Os
dibrometos vicinais podem sofrer desbromação quando tratados com iodeto de
sódio dissolvido em acetona, ou por uma mistura de pó de zinco dissolvido em
etanol.
MÉTODO DE DUMAS
Esse
processo consiste na eliminação do grupo carboxilato dos sais de ácidos
monocarboxílicos saturados a partir do contato com uma mistura denominada cal
sodada (NaOH + Ca(OH)2) a seco e a altas temperaturas.
Nesse
processo, o alcano formado apresenta um carbono a menos do que o sal que o
originou, uma vez que esse carbono formará o produto carbonato de sódio (Na2CO3).
DESIDRATAÇÃO
INTERMOLECULAR DE ÁCIDOS CARBOXÍLICOS
Esse
processo é semelhante ao processo de desidratação intermolecular entre álcoois.
Os principais agentes desidratantes são H2SO4(conc.), P2O5
ou H3PO4(conc.), todos sob aquecimento.






































Nenhum comentário:
Postar um comentário